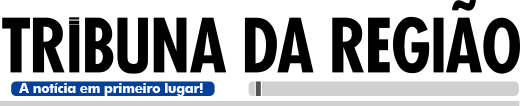
A Anvisa (Agência Nacional de Vigilância Sanitária) autorizou, nesta quarta-feira (9), a condução de uma pesquisa clínica da vacina ButanVac, do Instituto Butantan. Depois que a instituição apresentar algumas informações complementares, os testes com a vacina em humanos poderão ter início no Brasil.
A pesquisa clínica de fase 1 e 2 da Butanvac está dividida em três etapas (A, B e C). No momento, está autorizada a etapa A do estudo, que vai envolver 400 voluntários. Ao todo, a fase clínica 1 e 2 tem previsão de 6 mil voluntários com 18 anos ou mais.
Esta será a primeira vez que a Butanvac será aplicada em humanos. Para garantir a segurança dos voluntários, uma intensa troca de informações entre a Anvisa e o Instituto Butantan foi feita ao longo dos últimos dois meses.
![]()
A vacina será aplicada com duas doses em um intervalo de 28 dias entre a primeira e a segunda. O estudo deve ser realizado no Hospital das Clínicas da USP e no Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto.
Certificação de outro imunizante
Ainda nesta quarta, a Anvisa publicou a Certificação de Boas Práticas de Fabricação das plantas envolvidas na fabricação da vacina Covaxin, da empresa Bharat Biotech International Limited, na Índia. A empresa é fabricante do IFA (Insumo Farmacêutico Ativo) e também da finalizada vacina Covaxin.
A certificação tem validade de dois anos e foi emitida depois que a empresa realizou os ajustes necessários detectados por técnicos da Anvisa em março deste ano.
A agência enfatiza que o documento é pré-requisito para o registro da vacina, mas não para a autorização do uso emergencial e nem para a importação dos imunizantes.